Dermatosis purpúricas pigmentarias
12 septiembre, 2017
Displasias pilosas
12 septiembre, 20171. Diagnostico de laboratorio de las micosis cutaneas
Daniel Jesús Godoy Díaz, Miguel Lova Navarro, María Dolores Fernández Ballesteros, Elisabeth Gómez Moyano, Silvestre Martínez García, Vicente Crespo Erchiga. Servicio de Dermatología, Hospital Carlos Haya (Málaga).
2. Introducción
El Diagnóstico de laboratorio de las micosis cutáneas se realiza en dos etapas sucesivas. Por un lado la toma de muestra y por otro lado el procesamiento de ésta. El procesamiento comprende a su vez una serie de técnicas en las que destaca el examen directo y los cultivos, aunque no hay que olvidar la histopatología, la serología y las técnicas de biología molecular.
3. Toma de muestras
La calidad de la muestra es fundamental para alcanzar el diagnóstico. Para ello es necesario una serie de consideraciones básicas:
- No debe estar realizando tratamiento previo con antifúngicos. Si así fuese debe suspender el tratamiento al menos 2 semanas antes de la toma de la muestra.
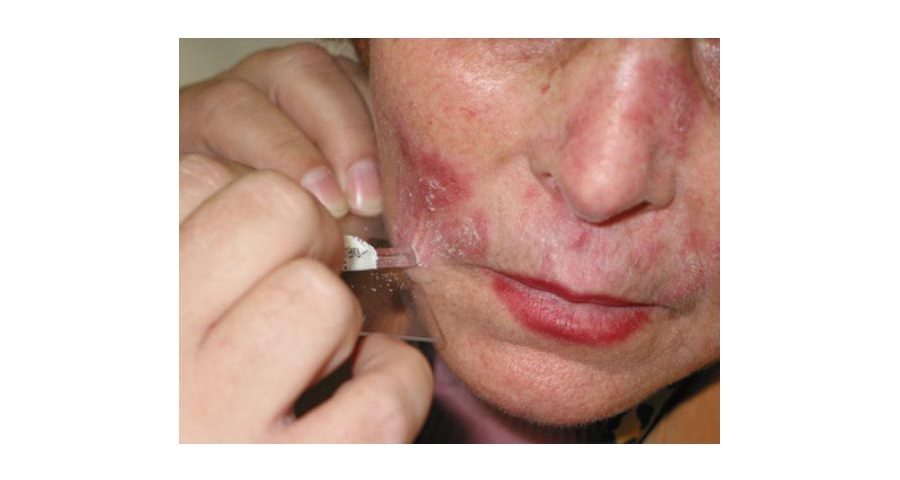
- La muestra debe tomarse del borde de la lesión, que es la zona más activa (figura 1).
- Recoger una cantidad suficiente de material patológico para las dos técnicas básicas de diagnóstico, el examen directo y el cultivo micológico.
- El instrumental para la recogida de la muestra (figura 2) es importante, de modo que en lesiones húmedas lo mejor es emplear escobillones con medio de cultivo. En lesiones secas deben rasparse con vacinostilos, hojas de bisturí o curettes. En onicomicosis es preferible tomar la muestra con la cucharilla del cuchillo de Le Cron (instrumento de uso habitual en Odontología). El material obtenido mediante raspado debe caer directamente sobre un portaobjetos o cartulina oscura para su mejor visualización.
4. Procesamiento de las muestras
La muestra debe procesarse lo más pronto posible, salvo en las infecciones por dermatofitos en la que no existe inconveniente en demorar el procesado, ya que éstos permanecen viables en el material parasitado durante semanas.
5. Examen directo
5.1. ¿Qué es el examen directo?
Es una técnica diagnóstica en la que se detecta el agente infeccioso directamente en la muestra patológica, con ayuda de un reactivo o colorante. Es una técnica muy rentable dado su sencillez y su bajo coste. Su especificidad es limitada, no obstante su sensibilidad es superior al cultivo.
5.2. ¿Cómo se realiza un examen directo?
Depositamos una parte de la muestra patológica en el centro de un portaobjetos y sobre él, una gota del reactivo elegido, normalmente solución de potasa (KOH). A la potasa en soluciones que varían del 20 al 40%, se le suele añadir Tinta Parker azul permanente. Esta tinta no tiñe los hongos de forma inmediata (salvo en la pitiriasis versicolor), pero sí al cabo de unas horas por lo que en caso de duda, puede repasarse la preparación transcurrido este tiempo.
Posteriormente se cubre con un cubreobjetos. Es necesario calentar la preparación con la llama de un mechero, y/o presionar repetidamente con la uña del dedo para conseguir disociar, es decir, disolver el material queratinoso bajo la acción de la potasa.
A continuación, se procede a la observación al microscopio, utilizando primero los aumentos bajos (10X) realizando un barrido, y después los al tos (20 y 40X) para mayor detalle.
5.3. ¿Cómo se interpreta un examen directo?
En cuanto a la interpretación del examen directo:
- Los dermatofitos aparecen en el examen directo como filamentos septados y ramificados, de bordes regulares y nítidos, hialinos, que toman lentamente el color azul de la tinta Parker (figura 3).
- Las levaduras suelen presentarse bajo el aspecto de blastoconidias y pseudomicelio.
- Los mohos oportunistas rara vez se observan en los exámenes directos, salvo en las onicomicosis donde es posible observar hifas y conidias.
- Debemos recordar la posible presencia de artefactos, susceptibles de interpretaciones erróneas, tales como las fibras textiles que pueden confundirse con hifas, aunque estas fibras presentan una coloración intensa, diámetro variable y bordes y extremos desflecados.
6. Cultivo micológico
6.1. ¿Qué es un cultivo micológico?
Una vez detectado la presencia de micosis con el examen directo, será el cultivo el que nos permita el aislamiento e identificación del hongo.
El cultivo se lleva a cabo depositando una cantidad de la muestra patológica en la superficie de uno o varios medios de cultivo, dispuestos en recipientes que pueden ser tubos o placas. Las placas Petri de 9-10 cm de diámetro permiten una mejor disposición del inóculo y facilitan la observación y el estudio de las colonias, aunque tienen la desventaja de ofrecer más riesgo de contaminación, no obstante este problema puede limitarse con la adición de ciertos antibióticos y practicando las siembras cuidadosamente.
Las placas o tubos, una vez inoculados, se incuban a temperatura ambiente o, mejor, en una estufa a 25ºC, que es la temperatura ideal para el desarrollo de la mayoría de las dermatomicosis.
Existe un número limitado de medios de cultivo destinado al asilamiento e identificación de los hongos. Como rutina, debe emplearse el medio glucosado de Sabouraud (SGA) con cloranfenicol o gentamicina, utilizando siempre dos placas del mismo, una de ellas contendrá también Actidiona, un antifúngico de la familia de los polienos que inhibe la mayoría de las especies contaminantes.
7. Bibliografía
- Crespo Erchiga V, Delgado Florencio V, Martínez García S, 2006: Micología dermatológica. MRA médica ed. Barcelona.
- Crespo Erchiga V, 1995: Dermatosis: diagnóstico de laboratorio. IM&C ed.Madrid.
- Armijo M, Crespo V, Delgado V, Pereiro M, Carapeto F, 1989: Dermatosis por hongos. EMISA ed. Madrid.
8. Véase también
- Antifúngicos sistémicos